
Würzburg, 3. November 2022 – Wissenschaftler:innen des Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI) und des Instituts für Molekulare Infektionsbiologie (IMIB) in Würzburg wollen besser verstehen, wie genau der Mundhöhlenkeim Fusobacterium nucleatum mit verschiedenen Krebserkrankungen in Verbindung steht. Um den molekularen Strategien dieser Bakterien auf die Schliche zu kommen, hat das Team neue genetische Werkzeuge entwickelt. Entdeckt wurde damit ein möglicher Regulator für das Anhaften der Mikroorganismen an Tumorzellen. Die Erkenntnisse dienen der Suche nach neuen therapeutischen Angriffspunkten und wurden kürzlich in dem Fachmagazin PNAS (The Proceedings of the National Academy of Sciences) veröffentlicht.
Mehr als 4.500 Bakterienarten besiedeln den Menschen. Obwohl ihre Bedeutung für Wohlbefinden und Gesundheit ebenso wie für Erkrankungen zunehmend erkannt wird, sind die zugrunde liegenden molekularbiologischen Zusammenhänge großteils noch unbekannt. Das gilt auch für Fusobakterien: Sie sind häufig in der Mundflora anzutreffen, können jedoch auch andere Stellen des menschlichen Körpers besiedeln, insbesondere Krebsgewebe. Dort fördern sie Tumorwachstum und Metastasen, erschweren die Behandlung und verschlechtern die Prognose. Diese Verbindung ist bereits vielfach bei Darm- und Brustkrebs nachgewiesen worden. Darüber hinaus stehen Fusobakterien zunehmend in Verdacht, auch bei Krebserkrankungen anderer Organe, etwa der Speiseröhre und Bauchspeicheldrüse, eine entsprechende Rolle zu spielen.
Doch wie gelingt es dem Mundhöhlenkeim, sich derart anzupassen, dass er auch außerhalb seines ursprünglichen Habitats überleben kann? Dies zu entschlüsseln, kann neue therapeutische Ansätze im Kampf gegen Krebs hervorbringen – und steht deshalb im Fokus der Forschung von Jörg Vogel, Geschäftsführender Direktor des Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI) in Würzburg und korrespondierender Autor der vorliegenden Studie. Seine Einrichtung ist ein Standort des Braunschweiger Helmholtz-Zentrums für Infektionsforschung (HZI) in Kooperation mit der Julius-Maximilians-Universität Würzburg (JMU), zu der auch das an den Untersuchungen beteiligte Institut für Molekulare Infektionsbiologie (IMIB) gehört.
„Fusobakterien sind klinisch höchst relevant, aber selbst noch wenig erforscht“, stellt Jörg Vogel fest. „Ein Ziel meiner Arbeitsgruppen am HIRI und IMIB ist es, auf molekularer Ebene zu verstehen, wie diese Mikroorganismen agieren.“ Daraus wolle man neue Strategien für therapeutische und diagnostische Ansätze ableiten, erklärt der Professor.
Auf der Fährte eines Anpassungskünstlers
Fusobacterium nucleatum ist ein Bakterienstamm, der sich im Laufe der Evolution früh von anderen bekannten Bakterien wie zum Beispiel Escherichia coli (E. coli) entfernt hat. Wissenschaftliche Erkenntnisse, die für den gut erforschten Modellorganismus E. coli gelten, können somit nicht notwendigerweise auf den Mundhöhlenkeim übertragen werden. Ebenso bedarf es neuer genetischer Werkzeuge, um dem Geheimnis der Fusobakterien auf die Spur zu kommen. Die bisherige Forschung hat sich ohne diese vor allem auf den Wirt konzentriert.
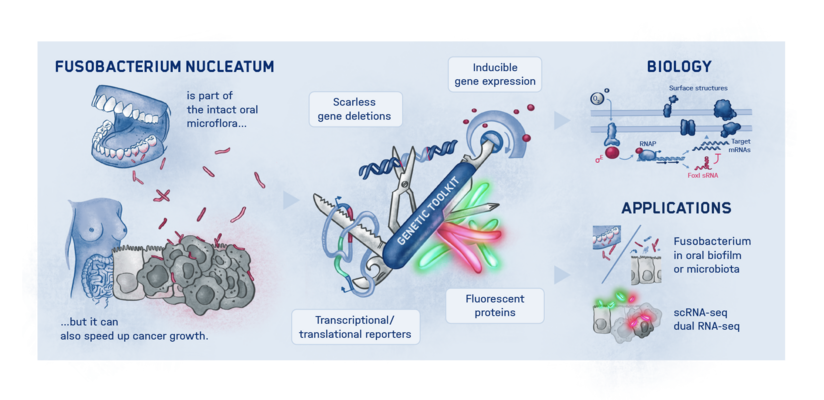
Genau hier setzen die Würzburger Wissenschaftler:innen an. „Wir haben ein dringend benötigtes Instrumentarium für den Einsatz in Fusobacterium nucleatum entwickelt und erstmals auch ein Fluoreszenz-Bildgebungsverfahren etabliert, mit dem wir die Mikroorganismen darstellen und verfolgen können“, erläutert Falk Ponath, Erstautor der kürzlich in dem Fachmagazin PNAS (The Proceedings of the National Academy of Sciences) erschienenen Studie. Mithilfe ihrer genetischen Werkzeuge hat das Team einen Faktor entdeckt, der womöglich zur Kontrolle der Adhäsion der Onkomikroben an Tumorzellen beiträgt.
Ponath: „In einer vorangegangenen Untersuchung hatten wir bereits festgestellt, dass eine kleine regulatorische Ribonukleinsäure, sogenannte sRNA, ein Protein der äußeren bakteriellen Zellmembran reguliert. Jetzt konnten wir diesen Mechanismus genauer analysieren und einen beteiligten spezifischen Anpassungsfaktor finden, der verschiedene Proteine der Zellhülle unterdrückt.“ Dieser Anpassungsfaktor zeigte sich unempfindlich gegenüber äußeren Stressoren, reagierte jedoch stark auf Sauerstoff. Das Gas aktivierte den Anpassungsfaktor, der wiederum die sRNA hochfuhr.
Das bereits von anderen Mikroben wie E. coli bekannte Regulierungsprinzip auch in Fusobacterium nucleatum nachweisen zu können, sei vor dem Hintergrund der evolutionären Distanz durchaus überraschend, so Ponath. Zugleich sei es verlockend zu spekulieren, dass der Anpassungsfaktor wie ein Sensor für die Bakterienumgebung fungiere und, vermittelt durch Sauerstoff, die Zellhülle umgestalte.
Fusobakterien nutzen die Proteine ihrer Zellhülle für die Interaktion mit dem Wirt. Ob jedoch die beschriebenen Prozesse ursächlich dafür sind, dass der Mundhöhlenkeim Tumorgewebe besiedelt, muss noch weiter untersucht werden. Die aktuellen Erkenntnisse und die neuen genetischen Tools sollen dazu beitragen, die weiterführende wissenschaftliche Forschung auf diesem Weg zu beschleunigen.
Förderung
Der Erstautor der Studie, Falk Ponath, und die Autorin Valentina Cosi wurden im Rahmen des Fellowship-Programms der Würzburger Vogel Stiftung Dr. Eckernkamp gefördert. Unterstützt wurde die Studie ferner aus Mitteln des Gottfried Wilhelm Leibniz-Preises der Deutschen Forschungsgemeinschaft (DFG) an Jörg Vogel sowie des Projekts Rbiotics im Bayerischen Forschungsnetzwerk bayresq.net.
Originalpublikation
Ponath F, Zhu Y, Cosi V, Vogel J (2022)
Expanding the genetic toolkit helps dissect a global stress response in the early-branching species Fusobacterium nucleatum.
The Proceedings of the National Academy of Sciences (PNAS), DOI: 10.1073/pnas.2201460119
Helmholtz-Institut für RNA-basierte Infektionsforschung
Das Helmholtz-Institut für RNA-basierte Infektionsforschung (HIRI) ist die weltweit erste Einrichtung ihrer Art, die die Forschung an Ribonukleinsäuren (RNA) mit der Infektionsbiologie vereint. Auf Basis neuer Erkenntnisse aus seinem starken Grundlagenforschungsprogramm will das Institut innovative therapeutische Ansätze entwickeln, um menschliche Infektionen besser diagnostizieren und behandeln zu können.
Das HIRI ist ein Standort des Braunschweiger Helmholtz-Zentrums für Infektionsforschung (HZI) in Kooperation mit der Julius-Maximilians-Universität Würzburg (JMU) und befindet sich auf dem Würzburger Medizin-Campus.




![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/0/c/csm_2025_05_Infection___Immunity_Poster_Webdatei_508d5dc6fa.png)





















![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/5/4/csm_2024_10_EUREKA__c_HIRI_Luisa_Macharowsky_3_low_01_863006bd0e.jpg)




































![[Translate to German:]](/fileadmin/HIRI/__processed__/3/3/csm_2022_07_BEISEL_Chase_2_cropped_Low_a7a341cf03.jpg)





































![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/2/8/csm_Collage_WUE_9fa1cd516c.jpg)











![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/0/8/csm_05_Saliba_02_c_HIRI_Luisa_Macharowsky_ohne_Lacoste_low_zugeschnitten_2_01_9822d73a3f.jpg)






![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/c/c/csm_HIRI-Grundstseinlegung_Foto__c_Mario_Schmitt_79ad64af6d.jpg)













![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/c/2/csm_2023_04_Smyth_Paper_c_HIRI_Luisa_Macharowsky_2_low_84f993d581.jpg)


































![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/e/2/csm_2022_11_HIRI_City_of_Wuerzburg_Child_Care_c_HIRI_Luisa_Macharowsky_2_low_6445b253eb.jpg)
![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/3/9/csm_HIRI_key_visual_CHurtig_606d992d74.jpg)





































![[Translate to German:] [Translate to German:]](/fileadmin/HIRI/__processed__/f/0/csm_Ahsen_blue2_6e28a4ee6b.jpg)














![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIRI/__processed__/a/5/csm_2022_02_Marco_Olguin_HIRI-Luisa_Macharowsky_04_low_new_3dc837191c.jpg)


![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIRI/__processed__/3/c/csm_Joerg_Vogel_Portrait_-_photocredit_Mario_Schmitt__c__HIRI_5013b9643b.jpg)






![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIRI/__processed__/a/6/csm_RNA_Delivery_1902376336.jpg)
![[Translate to Deutsch:]](/fileadmin/HIRI/__processed__/7/c/csm_Caliskan_Kibe_Pekarek_105c7d1860.jpg)
![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIRI/__processed__/c/1/csm_N-Caliskan_M-Zimmer_Zoom_c93c493293.jpg)













































